королевского общества, где Ньютон отмечал, что световые лучи ,
различаются в их способности показывать ту или иную особую окраску точно
так же, как они различаются по степени преломляемости. Цвета не являются,
как думают обыкновенно, видоизменениями света, претерпеваемыми ими при
преломлении или отражении от естественных тел, но суть первоначальные,
прирожденные свойства света. Критиками Ньютона выступали Гук, Гюйгенс и др.
В 1802 г. Вильям Волластон, английский естествоиспытатель, известный своими
исследованиями в области химии, физики, кристаллографии, минералогии,
ботаники, медицины, произвел следующий опыт. Солнечные лучи пропускались
в комнату через щель шириной 1,25 мм и рассматривались через хорошую призму
на расстоянии 3 м от щели. При этом отдельные спектральные области оказались
отдаленными друг от друга тонкими черными линиями. Разлагая прямой свет
голубой части пламени свечи, Волластон нашел, что здесь нет непрерывного
спектра и свет разлагается на пять отдельных полос, удаленных друг от
друга.
В 1817 г. темные линии в спектре тщательно изучил немецкий оптик Йозеф
Фраугофер. Он усовершенствовал изготовление больших ахроматических
объективов, изобрел окулярный микрометр и гелиометр, наблюдал и объяснил
наличие линий поглощения в солнечном спектре. В 1821 г. Фраунгофер применил
дифракционную решетку для изучения спектров. При измерении дисперсии света
в качестве источника служила свеча. При этом он обнаружил в спектре яркую
желтую линию. В работе 1815 г. он писал: "Я решил выяснить, можно ли
видеть подобную светящуюся линию в солнечном спектре. И с помощью телескопа
я обнаружил не одну линию, а большое количество вертикальных линий, резких
и слабых. Слабые оказались темнее остальной части
- 11 -
спектра, а некоторые из них были совершенно черными..."
Фраунгофер обнаружил, что желтая линия в спектре свечи в точности совпадает
с темной линией D в солнечном спектре. Для исследования спектров он
изготовил решетки из тонких, близко расположенных параллельных нитей; кроме
того, он наносил на стеклянную пластинку параллельные штрихи. Решетки,
изготовленные им, содержали свыше 300 линий на миллиметр. Опыты Фраунгофера
по исследованию спектров продолжали Давид Брюстер, Джон Гершель и Фокс
Тальбот.
Во второй половине XIX века широкое развитие получило изучение спектров
поглощения. Сплошной спектр имеет вид непрерывной полосы, содержащей все
части видимого спектра. Линейчатый спектр состоит из определенного числа
отдельных линий в спектре. Спектральные линии группируются в серии. Линии в
пределах серии сближаются при переходе к более коротким длинам волн.
Полосатый спектр состоит из широких полос, более ярких с одной стороны.
Пропустив белый свет через среду, поглощающую те или иные лучи, получают
спектр поглощения, представляющий сплошной спектр, от которого отняты
определенные цвета.
В 1860 г. Густав Кирхгоф и Роберт Бунзен в работе "Химический анализ с
помощью спектральных наблюдений", писали , что ни различие форм
соединений, в которых участвуют металлы, ни разнообразие химических
процессов в отдельных пламенах, ни громадное различие температур этих
пламен, нисколько не влияют на положение спектральных линий, соответствующих
отдельным металлам. Больше всего внимание экспериментаторов
привлекал к себе линейчатый спектр. Появилось немало работ, посвященных
исследованию спектров различных веществ в зависимости от физических условий.
Плюккер и Гитторф указали, что азот, пары серы и некоторых углеводородов в
зависимости от физических условий могут дать два или три различных спектра.
Оказалось, что при некоторых условиях пары и газы могут давать непрерывный
спектр. На протяжении пятидесяти лет (1860-1911) было измерено 120 000 линий
между ![]() = 2000 и
= 2000 и ![]()
= 7000 А.
Вслед за ранними исследованиями спектров различных элементов появи -лись и
первые попытки найти определенные закономерности в распределении спектральных
линий. Такую попытку сделал в 1863 г. Маскар, а затем Стонер, Шустер и др.
В 1885 г. Иоган Якоб Бальмер установил , что длины волн соответствующие
некоторым линиям спектра водорода хорошо укладываются в формулу:
![]()
![]()
где: ![]() - целое число;
- целое число;
- 12 -
![]() - постоянная;
- постоянная;
![]() - длина волны.
- длина волны.
Эту формулу оказалось удобнее выразить в виде:
![]()
![]() ,
, ![]() = 3, 4, 5, ...
= 3, 4, 5, ...
где: ![]() - частота;
- частота;
![]() - постоянная Ридберга.
- постоянная Ридберга.
К систематике атомных спектров испускания относятся работы шведского физика
Йоханнеса Ридберга. Он показал, что расположение линий в спектрах многих
элементов подчиняется закономерностям, записываемым как разность двух
выражений - термов:
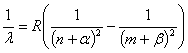 ,
,
где: ![]() и
и ![]() - поправки в сериальной формуле;
- поправки в сериальной формуле;
n и m - целочисленные значения.
Вальтер Риц - немецкий физик и математик - предложил поправки в сериальные
формулы и сформулировал комбинационный принцип. Сущность принципа в том,
что термы, принадлежащие различным сериям данного спектра, можно
комбинировать друг с другом. Комбинация дает соответствующие спектральные
линии. Комбинационный принцип позволяет, если известен ряд частот
спектральных линий данного элемента, предсказывать существование других
линий элемента. Однако наблюдаются не все возможные частоты спектральных
линий, предсказанные на основании комбинационного принципа. Часть этих линий
может быть запрещена правилами отбора.
У щелочных металлов Ридберг установил наличие трех серий. Эти серии были
названы главной, первой побочной и второй побочной. Сериальные формулы
имеют вид:
Главная серия ![]() , n = 2, 3, 4,.
, n = 2, 3, 4,.
Первая побочная серия ![]() , n = 3, 4, 5,.
, n = 3, 4, 5,.
- 13 -
Вторая побочная серия ![]() , n = 2, 3, 4, ...
, n = 2, 3, 4, ...
где: A - предел главной серии;
В - предел первой и второй побочных серий;
s, p, d - поправки к квантовым числам.
В 1908 - 1909 гг. Фридрих Пашен обнаружил две первые линии инфракрасной
спектральной серии водорода, названой серией Пашена. Эти линии подчиняются
формуле:
![]() .
.
Генрих Рубенс и его ученики проследили тепловые инфракрасные лучи до 0,3 мм.
В 1911 г. Рубенс и Байер обнаружили инфракрасные лучи с длиной волны![]()
= 342 мкм и 218 мкм. Сложнее дело обстояло с продвижением в изучении
ультрафиолетового спектра. В 1898 г. Шуман дошел до 130 мкм, Лайман в 1906
г. - до 100 мкм.
"Отысканием сериальных закономерностей до 1913 г. - писал Д. С.
Рождественский, - руководила чистая эмпирика, комбинаторика чисел, в основе
которой нельзя было еще усмотреть закона природы. Поэтому символика
спектральных серий имела несколько кабалистический вид, отталкивавший многих
физиков от этой области науки". Комбинационный принцип, установленный
Ритцем, который смог бы служить некоторой опорой в поисках
закономерностей спектральных серий, не укладывался в рамки математической
физики. Изучение электромагнитных волн связывалось с определенными
движениями заряженных частиц. При представлении этих движений в виде ряда
Фурье возникают частоты, кратные основной частоте; но в спектре излучения
такие линии не наблюдались. Из простых спектральных закономерностей вытекали
два существенных вывода:
1) частота входит в формулу в первой степени;
2) линии любой серии по мере приближения к пределу, при n![]()
, располагаются все гуще, т.е. ряд частот должен быть дискретным, имея предел
на конкретном расстоянии.
Поскольку классическая электродинамика категорически утверждала, что
частота излучения однозначно определяется частотой колебаний излучателя,
возникал вопрос, каковы должны быть осцилляторы, чтобы испускаемые
спектральные линии удовлетворяли этим двум требованиям. Ответ на этот вопрос
приводил к большим осложнениям. Еще Рэллей обратил внимание на следую-
- 14 -
щее обстоятельство. Для любой системы, движение которой определяется обычными
уравнениями механики, всегда получаются соотношения, куда входят квадрат
частоты, а не сама частота, как этого требуют спектральные закономерности.
Уравнения движения всегда содержат ускорение, а поскольку при периодических
движениях время обычно входит в виде ![]()
![]()
, то значит, вторая производная по времени неизбежно содержит ![]()
.Значит, для получения правильных сериальных формул нельзя воспользоваться
моделью упруго или квазиупруго связанного электрона.
Пытаясь обойти эту трудность, Ритц предложил атомную модель, в которой силы,
вызывающие колебания электронов, зависели не от их смещения, а от скорости.
Тогда ускорения будут представлены как первые производные скорости по
времени, а, следовательно, частоты войдут в уравнения в первой степени.
Этому условию удовлетворяют магнитные силы. Ритцу удалось получить формулу
Ридберга-Ритца, но ценой весьма искусственных предположений о происхождении
этих сил и о расположении магнитиков-электронов.
Вторую причину необходимости отказа от квазиупругой силы модели указал
Пуанкаре. Независимо от природы квазиупругой силы собственные частоты
вызванных ею колебаний определяются волновым уравнением ![]()
. Пуанкаре показал, что никакими граничными условиями нельзя добиться, чтобы
ряд собственных значений имел предел на конечном расстоянии. Отсюда следовало,
что частоты не подчиняются спектральным формулам.
"На первый взгляд, - писал Пуанкаре, - изучение спектрального
распределения приводит нас к мысли о гармониках, с которыми мы уже
встречались в акустике. Однако имеется существенное различие: не только
волновые числа кратны одной и тоже величине, но мы не находим здесь
также никакой аналогии с корнями тех трансцендентных уравнений, к которым
так часто приводят задачи математической физики. Спектральные законы проще,
но они имеют совершенно другую природу. "Эту вторую трудность пытались
обойти путем построения подходящих колебательных систем, идя обратно, от
комбинационного принципа. Рикке, Ритцу, Фредгольму удалось довести эти
построения до конца, но полученные при этом дифференциальные уравнения
были столь сложны, что дать им удовлетворительную физическую интерпретацию
оказалось невозможным.
Учение о спектрах вызывало необходимость создания теории строения атома и
законопеременности оптического спектра, она должна была привести к
результатам, которые согласуются с опытными данными по дисперсии и эффекту
Зеемана, а в дальнейшем найти объяснение характеристическим рентгеновским
спектрам и эффекту Штарка. Постепенно стали приходить к убеждению, что
решить эту задачу в рамках классической электродинамики невозможно. Этому
в немалой степени способствовали работы Эйнштейна, успешно приме-
- 15 -
нившего квантовые представления в теории теплоемкости и при рассмотрении
фотоэффекта, фотохимических явлений, рентгеновского излучения.
Квантовые представления в той или иной форме применялись еще до работ Бора
при рассмотрении отдельных вопросов, связанных со строением атомов и молекул.
Нерст рассмотрел молекулярные спектры в предположении, что имеет место
квантование вращения молекул. Бьеррум, развил идею Нернста, провел расчет
спектра испускания двухатомной молекулы, полагая, что при ее вращении с
частотой ![]() вокруг
вокруг
линии, соединяющей оба атома, энергия вращения кратна ![]()
(![]() - постоянная
- постоянная
Планка).
Никольсон воспользовался моделью, предложенной Нагаока. Согласно этой
модели атом состоит из центральной положительно заряженной частицы, вокруг
которой с общей угловой скоростью вращаются кольца, заполненные электронами.
Спектры объяснялись колебаниями колец в целом. В дальнейшем Бор указал
на основные трудности и недостатки этой теории.
У Никольсона соотношения между частотами, соответствующие опреде- ленным
линиям, сравнимы с соотношениями между частотами, соответству- ющими различного
рода колебаниями электронного кольца. Он в одной из своих работ, стремясь
объяснить наблюденные им спектры астрономических объектов, предположил, что
момент импульса электронных колец кратен ![]()
. К проблеме устойчивости Никольсон не подходил.
Бор увлекся теоретическими проблемами, связанными с моделью Резер- форда,
весной 1912 г., сразу же после приезда в Манчестер. Его привлекла
возможность отчетливого разделения тех физических свойств элементов, которые
определялись непосредственно ядром, от тех, которые вызваны распределением
электронов в атоме.
К середине 1912 г. была уже готова значительная часть работы "О строении
атомов и молекул", но Бор продолжал исследовать роль кванта действия в
электронном строении атома в связи с проблемами излучения. Трудности
возникали из-за вопроса устойчивости атома. Ранней весной 1913 г. он нашел
решение, когда вовлек в рассмотрение простейшие спектральные закономерности.
- 16 -
4. ТЕОРИЯ АТОМА БОРА.
В 1913 г. в английском журнале "Philosophikal Magazine" была опубликована
статья Н. Бора "О строении атомов и молекул". Статья состояла из трех
частей. Первая часть озаглавлена "Связывание электронов положительным
ядром", вторая - "Системы, содержащие только одно ядро", третья -
"Системы с несколькими ядрами".
В статье излагалась новая теория строения атома. "Введение" к статье Бор
начал с краткой характеристики модели атома Резерфорда, согласно которой
атом состоит положительно заряженного ядра и системы окружающих его
электронов. Силами притяжения электроны удерживаются на определенных
расстояниях от ядра. Положительный заряд ядра и общий отрицательный заряд
электронов равны между собой. Линейные размеры ядра очень малы по сравнению
с линейными размерами атома в целом. Основная часть массы атома заключена в
ядре. Бор полностью принял модель атома, предложенную Резерфордом. Он
считал, что вокруг ядра атома водорода вращается только один электрон и
заряд ядра Е = е; в атоме гелия вращаются два электрона, в
атоме лития - три электрона и т.д.
До Резерфорда в физике господствовала модель атома Дж. Дж. Томсона,
согласно которой атом состоит из шара, равномерно заполненного положи-
тельным электрическим зарядом. В этом шаре электроны движутся по
окружностям. Основное различие между моделями Томсона и Резерфорда Бор
усматривал в том, что в модели Томсона силы, действующие на электроны,
допускают такие конфигурации и движения, которое обеспечивают устойчивое
равновесие системы, в то время как для модели Резерфорда, по-видимому,
такие конфигурации не существуют. Это различие проявляется в том, что среди
величин характеризующих атом Томсона, имеется одна величина - радиус
положительно заряженного шара - с размерностью длины, в то время как среди
величин, характеризующих атом Резерфорда, такая длина отсутствует.
Теория теплового излучения Планка и прямые подтверждения существо-вания